1 Sprech- und Darstellungsweisen auf dem Prüfstand
Reinstoffe sind auf der Stoffebene von zentraler Bedeutung. Chemiker/innen bezeichnen sie u.a. mit Hilfe chemischer Formeln, die aber eigentlich Informationen über die Teilchen und Teilchenverbände des Stoffes, nicht über den Stoff selbst liefern. Obwohl nun aber die Teilchenebene Erklärungen für die Phänomene auf Stoff- (bzw. Portions-) Ebene liefern soll, wird über eine Bezeichnung für die "klein(st)en Teilchen" der Reinstoffe immer noch heftig diskutiert - oder man umgeht dieses Minenfeld einfach durch Benutzung des allgemeinen Begriffs "Teilchen", der aber genauso auf Atome, Elektronen, Protonen, Neutronen, Photonen etc. anwendbar ist. Oder man reduziert didaktisch auf den Molekülbegriff der Antike, was von vielen Kolleg/inn/en aber als falsch angesehen wird. Der einzige hier korrekte und gleichzeitig allgemein akzeptierte differenzierte Begriff wäre die Formeleinheit. Diese ist aber für Schüler/innen im Anfangsunterricht nicht so recht als Teilchen (be)greifbar. Deshalb wird dieser Begriff sehr selten und meist auch nur für Salze gebraucht. Ein anderer, klar abgegrenzter Teilchenbegriff ist daher nötig. An Vorschlägen mangelt es nicht: Elementargruppe, (Kleinst-) Baugruppe, Kleinstteilchen, Baustein, Stoffteilchen, ..., nur konnte sich bisher keiner davon wirklich etablieren.
2 Verwirrungspotenzial obiger Sprech- und Darstellungsweisen
Das Problem ist zunächst, dass der Molekülbegriff älter ist als der Atombegriff (und damit auch älter als die Chemie als moderne Naturwissenschaft), weshalb Physiker/innen (und auch viele Chemiker/innen im angelsächsischen Raum) die kleinsten Teilchen von Reinstoffen immer noch als Moleküle bzw. Molekel ansprechen, selbst wenn es sich um Stoffe mit Gitterstruktur (wie z. B. Kochsalz) handelt. Als nun aber die Chemiker/innen durch die klassischen Analysereaktionen auf elementare Stoffe stießen, war klar, dass die meisten "Molekeln" aus mindestens zwei Grundbausteinen, den Atomen, bestehen, meist sogar aus Atomen verschiedener Atomsorten.
DALTONs Fehlvorstellung von Atomen als Formeleinheiten der elementaren Stoffe hat sich in der Fachwelt nicht lange gehalten - aber umso hartnäckiger in den Köpfen der Schüler/innen, weil die Teilchen nicht begrifflich auseinandergehalten wurden und weil der Elementbegriff homonym - im makroskopischen Sinne als Stoff (also besser: elementarer Stoff) und im submikroskopischen Sinne (als Atomsorte) - definiert wurde.
Daraus ergeben sich mehrere Probleme:
A) Wenn man als Lehrer/in die klassische Definition weitergibt "Atome sind die kleinsten Teilchen der Elemente", geht man das erhebliche Risiko ein, dass ab diesem Zeitpunkt ein verhängnisvoller Trugschluss gezogen wird: Das Atom wird als Formeleinheit aller elementaren Stoffe gesehen. BARKE spricht in solchen Fällen von hausgemachten Fehlkonzepten [BARKE 2015, S. 229]. Hier könnte allerdings das Periodensystem PSE³ Abhilfe schaffen, wie in KREMER & BEE (2017) gezeigt wird. Außerdem birgt die unreflektierte Verwendung eines Begriffes (Element) für zwei ganz unterschiedliche Dinge (elementarer Stoff vs. Atomsorte) die Gefahr, dass eine Unterscheidung erschwert oder unmöglich wird, was sich sogar auf die Trennung zwischen mikro- und makroskopischer Ebene auswirkt.
B) Wenn unreflektiert der Begriff „Element“ zwischen submikroskopischer und makroskopischer Ebene wechselt, und Verbindungen aus (in gleicher Weise missverstandenen) „Elementen“ bestehen, dann assoziieren Schüler/innen häufig, dass in Portionen von Verbindungen die Portionen der elementaren Stoffe gemischt vorliegen. Anlässe für dieses Fehlkonzept sind oft gehörte, zwar richtige, aber gleichwohl hochproblematische Aussagen wie etwa: "Die Verbindung Wasser enthält die Elemente Wasserstoff und Sauerstoff", oder gar zitiert aus einem Schulbuch: "Elemente sind [...] Stoffe [...]. [...] Wasser ist eine Verbindung aus den Elementen Wasserstoff und Sauerstoff" [JÄCKEL 1996, S. 52 und 98].
C) Auch kommt es bei dieser Herangehensweise oftmals zur Fehlvorstellung, beim Sieden eines Reinstoffs zerfalle dieser in seine Atome: Das Aggregat seiner "kleinsten Teilchen" löst sich nach dem einfachen Teilchenmodell auf, da ihr Zusammenhalt verloren geht - und mit kleinsten Teilchen assoziieren Schüler/innen im klassischen Chemieunterricht zuerst einmal „Atome“.
D) Eine weitere typische Fehlvorstellung ist, hinter jeder chemischen Formel einfach eine zusammenhängende Gruppierung von Atomen zu sehen. Solche für sich abgeschlossene Atom-Gruppen als kleinste Teilchen findet man aber eben nur in Form von Molekülen und ungeladenen Komplexen. Hier halten Atome durch gemeinsame Elektronen fest zusammen. Zwischen den aus diesen Bindungen resultierenden „Formeleinheiten“ und anderen Teilchen bestehen (anziehende) Wechselwirkungen (TITTEL & KREMER 2017).
E) Bei Salzen ist die Problematik noch gravierender. Zunächst einmal ist unstrittig, dass es sich bei einem reinen Salzkristall (hier im Sinn von: kein Mischkristall) um eine Reinstoff-Portion handelt. Für Lernende stellt sich die Frage: Wie kann ein Salz ein Reinstoff sein, wenn es aus verschiedenen Teilchen (Ionen) besteht? Hier stellt also ein weiterer undifferenzierter Teilchenbegriff erneut eine logische Stolperfalle dar.
Nun können aber Ionen nicht die kleinsten Teilchen reiner Salze sein, denn kleinste Teilchen von Reinstoffen müssen aufgrund ihrer Anziehungskräfte Kristalle und Schmelzen bilden - gleichnamige Ionen können das aufgrund ihrer Abstoßung aber nicht.
Also muss man eine ungeladene Formeleinheit aus verschiedenen Ionen als „kleinstes Teilchen“ festlegen. Da es sich bei dieser Formeleinheit nun um eine definierte Kombination von Teilchen (Ionen) handelt, kann man diese Kombination selbst wiederum modellhaft als Teilchen auffassen. Solche Formeleinheiten spricht man mit den Begriffen Ionenpaar oder nach BARKE (2015) besser Ionengruppe an (weil es eben nicht immer Paare sind, sondern wie z. B. im Calciumfluorid eine Dreiergruppe). Man formuliert mit Formelschreibweisen dieser Teilchen Reaktionsgleichungen und „zählt“ sie bei Angaben der Stoffmenge in der Einheit Mol. Auch wenn es im Kristall für die Zusammenfassung der Ionen zu Ionengruppen verschiedene Möglichkeiten gibt, so gehört doch immer zu einer bestimmten Zahl Kationen auch eine bestimmte Zahl Anionen. Insgesamt stellt die „Ionengruppe“ ein „gedachtes“ Teilchen dar, und zwar einen kleinstmöglichen Gitterausschnitt mit dem richtigen Anzahlverhältnis der beteiligten Ionen. Dieser mikroskopische Sachverhalt drückt sich auch makroskopisch aus, man spricht von der Elektroneutralität von Stoff-Portionen und von der resultierenden Elektroneutralitätsbedingung bei Redoxreaktionen.
F) In Atomkristallen, wie z.B. im Diamant, sind alle Atome durch Elektronenpaarbindungen zu einem Kristall verknüpft. Die Formeleinheit ist hier die Portion, um die sich der Kristall vergrößern oder verkleinern lässt, ohne dass die Stoff-Eigenschaften sich ändern. Wie bei Salzen zwischen Ionen, so gibt es auch hier Bindungen zwischen Atomen verschiedener Formeleinheiten. Selbstverständlich muss man einräumen, dass ein C-Atom noch keinen Diamanten macht. Dies kann man leicht deutlich machen, indem man auf die anderen Modifikationen der jeweiligen Elemente verweist, die auf unterschiedliche Bindungsverhältnisse zurückgehen.
G) Metalle: Auch hier kann man zu Portionen einzelne Formeleinheiten hinzufügen oder wegnehmen, ohne dass die Stoff-Eigenschaft verloren geht. Die Atome sind durch eine metallische Bindung verknüpft. Die „gedachten“ Formeleinheiten halten dabei genau wie bei Salzen und Atomkristallen durch chemische Bindungen (Metallbindung) zusammen.
H) Edelgase: Hier existieren Atome, die wie bei den Metallen Formeleinheiten darstellen, allerdings ohne sich durch chemische Bindungen mit anderen Atomen stabilisieren zu müssen.
Aus A bis H geht klar hervor, dass Chemiker/innen unter Formeleinheiten eben nicht nur Moleküle verstehen, sondern auch andere "Systeme" aus Atomen. In der Chemie wurde bisher versäumt, sich auf einen anschaulichen Teilchen-Begriff für die Formeleinheit zu einigen. Leider, denn schlussendlich muss man klar festhalten, dass diese Vielfalt an Typen von Formeleinheiten einen Lernenden nicht nur verwirren kann, sondern letztlich gar muss. Vor allem dann, wenn ein undifferenzierter Teilchenbegriff verwendet wird, der auch für Atome und subatomare Teilchen herhalten muss. Ohne die Differenzierung der Formeleinheiten von den Atomen ist das Verständnis dieser grundlegenden Zusammenhänge bestenfalls schwierig, für allzu viele Schüler/innen aber sogar unmöglich. Und ehrlicherweise kann man auch die Frage stellen: Wie viele ausgebildete Naturwissenschaftler sind sich dieser Vielschichtigkeit immer bewusst? Leider ist die Formeleinheit als Begriff für ein Teilchen untauglich, weil Lernende sie rein sprachlich nur schwer als Teilchen begreifen können. Das Abstraktionsproblem der chemischen Formel wurde in der chemischen Didaktik mit dem erkenntnistheoretischen Dreieck Stoffebene - Teilchenebene - Formelebene von JOHNSTONE (2000) beschrieben. Der Abstraktionsgrad ist unnötig hoch, wenn die Formeleinheit nicht als Teilchen angesehen und verstanden wird.
3 Anregungen zur Minimierung von Verwirrung und Verständnisschwierigkeiten
Der Begriff "Stoffteilchen" als Ergänzung zum Begriff "Formeleinheit"
All diese Probleme lassen sich durch eine einfache Klärung umgehen: Gemisch-Portionen bestehen aus Reinstoff-Portionen, diese bestehen aus Formeleinheiten, diese wiederum aus (ggf. veränderten, etwa bei Ionen) Atomen. Die Formeleinheiten elementarer Stoffe enthalten nur eine Atomsorte, die von Verbindungen zwei oder mehrere.
Die Formeleinheit ist also der Dreh- und Angelpunkt der Differenzierung von Gemischen und Reinstoffen, von Verbindungen und elementaren Stoffen. Sie ist das Bezugsobjekt bei der Quantifizierung einer Stoffportion durch die Stoffmenge in Mol, bei molaren Stoffkonstanten wie molarer Masse, Bildungsenthalpie, Verdampfungsenthalpie etc. Wir brauchen sie zur Klärung der stöchiometrischen Verhältnisse in Mindestumsätzen usw. Wenn man nun aber die Formeleinheit modellhaft als kleinste Portion des Reinstoffs auffasst, wird sie zu einem Teilchen und wird damit – auch mit Hilfe von Modellen – zu einem wenn auch submikroskopischen, so doch bildlich vorstellbaren, Etwas.
Es handelt sich jeweils um das kleinste Teilchen des Reinstoffs. Portionen dieses Reinstoffs setzen sich daraus zusammen. Diese Teilchen bedingen die Eigenschaften der Stoffportion, sie machen den Stoff aus. Als ich zum ersten Mal den Begriff Stoffteilchen hörte, hatte ich endlich eine begriffliche Teilchen-Repräsentation für die Formeleinheit gefunden. Diese bildhaften Modellvorstellungen lassen sich einfach grafisch umsetzen und öffnen vielfältige Fenster für verständnisfördernde Visualisierungen. Einige Beispiele finden sich in den Abbildungen 1 und 2.
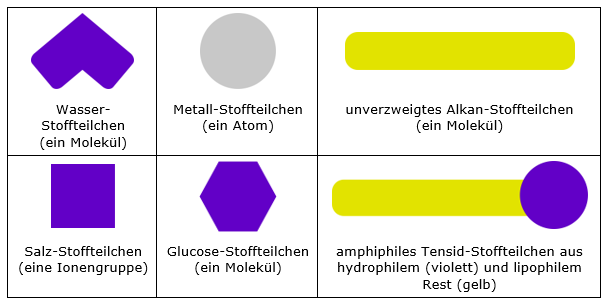
Abb. 1. Symbolvorschläge für ein undifferenziertes (einfaches) Stoffteilchenmodell mit den Farben Violett für Hydrophilie und Gelb für Lipophilie
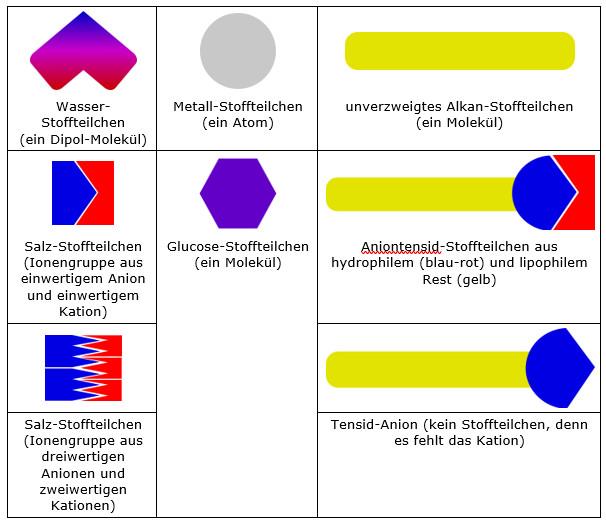
Abb. 2. Symbolvorschläge für ein differenziertes Stoffteilchenmodell mit den zusätzlichen Farben Blau für negative und Rot für positive (Partial-) Ladung
Der enge Zusammenhang zwischen mikroskopischer, makroskopischer und Symbolebene lässt sich sprachlich mit Hilfe des Begriffs Stoffteilchen ganz leicht ausdrücken, zum Beispiel: Wasser-Teilchen sind die Teilchen, aus denen jede Wasser-Portion besteht oder „die kleinste theoretisch denkbare Wasser-Portion“. (Diese Vorstellung wird bei Schüler/innen gelegentlich bereits in der Vorschule angelegt. Auf die Frage, wie viele Stoffteilchen in einer Stoffportion nötig sind, damit aus Teilcheneigenschaften Stoffeigenschaften resultieren, wird zunächst nicht zwingend eingegangen.)
Reines Wasser ist ein Reinstoff. Also ist das Wasser-Teilchen ein Stoffteilchen. Seine chemische Formel gibt seine Zusammensetzung aus den Atomen der verschiedenen Atomsorten wieder. Das Stoffteilchen von Wasser ist ein Molekül, deshalb ist Wasser ein molekularer Stoff.
Führt man schon mit dem einfachen Teilchenmodell den Begriff Stoffteilchen ein, so lässt sich diesem Wissen ein Atommodell nahtlos anschließen; es gibt keine Brüche im Teilchenmodell wie früher - nur Präzisierungen.
Es ist ratsam, Stoff und Teilchenart immer mit einem Bindestrich zu trennen und darauf zu achten, stets beides zu bezeichnen. Dies wird sofort klar, wenn man Wasserstoffteilchen und Wasser-Stoffteilchen gegenüberstellt. Die Bezeichnung Wasser-Stoffteilchen ist eindeutig. Mit einem Wasserstoffteilchen allerdings können je nach Kontext sowohl Wasser-Stoffteilchen als auch Wasserstoff-Stoffteilchen, Wasserstoff-Atome oder Wasserstoff-Moleküle gemeint sein.
4 Abwägung
Verwendung von „Stoffteilchen“ gegenüber alternativen Teilchenbegriffen
Den undifferenzierten Begriff "Teilchen" für die Formeleinheit sollten allenfalls Lernende nutzen, die versuchen, eine Modellvorstellung selbst zu umschreiben. Lehrkräfte sollten den Schüler/inne/n jedoch die besondere Bedeutung der Formeleinheit deutlich machen, indem sie einen differenzierten Begriff verwenden. Dann ist auch eine klare Unterscheidung der verschiedenen Wechselwirkungen zwischen Teilchen möglich, die hier bereits zur Diskussion stand [TITTEL & KREMER 2017]. Gegen eine Rückkehr zum antiken Molekül-Begriff spricht die Tatsache, dass dieser in der modernen Chemie bereits eine engere Bedeutung erfahren hat und mit dieser etabliert wurde.
Bausteine sind Objekte, die man je nach Bauanleitung zu verschiedenen komplexeren Strukturen zusammensetzen kann. Nutzt man die Metapher "Baustein" für Atome, so wird deutlich, dass Atome je nach Kombination verschiedene Formeleinheiten ergeben. Aus vielen gleichen Formeleinheiten lassen sich dagegen nur Stoff-Portionen aufbauen, die sich lediglich in ihrer Quantität unterscheiden. Deshalb sollte man besser Atome als Bausteine von Formeleinheiten (resp. Stoffteilchen) ansprechen, statt die Formeleinheiten selbst als Bausteine von Stoff-Portionen zu bezeichnen.
Mit dem Baugruppen-Begriff kann man richtig den Aufbau aus Atomen assoziieren - allerdings gibt es jedoch auch Formeleinheiten aus nur einem Atom (Metalle, Edelgase), was eine Bezeichnung als Gruppe ad absurdum führt. Elementargruppen bilden nur noch ein weiteres Wort im Wortfeld "Element", das mit den Begriffen Element, elementaren Stoffen und Elementarteilchen schon überstrapaziert ist. Aus diesem Grund sollte man eher über die Differenzierung der Elemente von elementaren Stoffen hinausgehen und im entsprechenden Kontext statt von Element von der Atomsorte sprechen. Zumal hier ebenfalls das Wort „Gruppe“ enthalten ist, dessen Verwirrungspotential bereits oben diskutiert wurde.
Der Begriff "kleine Teilchen" ist irreführend, weil er als Ergänzung zu den Atomen als "kleinste Teilchen" zu sehen ist - obwohl die Schüler/innen aus dem Physik-Unterricht noch viel kleinere „kleinste Teilchen“ kennen.
Anschlussfähigkeit des Stoffteilchen-Begriffs
Das im Anfangsunterricht früher verwendete Kugelteilchenmodell, das letztlich nichts anderes ist als eine Modellvorstellung von Stoffteilchen in Kugelform, lässt sich ohne an Anwendbarkeit und Aussagekraft zu verlieren, durch das Stoffteilchenmodell (mit Freiheit der Form) ersetzen. Dadurch gewinnt diese Modellvorstellung didaktisch ungemein, denn sie verliert den Makel der unzureichenden Anschlussfähigkeit. Gleichzeitig ist das schlüssigere und für Lernende einfachere Stoffteilchenmodell aber auch noch näher an der Fachwissenschaft, denn das wissenschaftliche Teilchenmodell ist eben gerade nicht auf die Kugelvorstellung beschränkt.
Stoffteilchen und Stoffteilchenmodell bleiben aber nicht auf den Anfangsunterricht beschränkt, sondern tragen nach einer fortschreitenden, darauf aufbauenden Differenzierung der Teilchenvorstellung weiter bis an die Hochschule. Denn auch da gilt: Das einfachste einen Sachverhalt brauchbar erklärende und Vorhersagen zulassende Modell wird bevorzugt verwendet. In diesem Zusammenhang sei beispielsweise auf das in Abbildung 1 gezeigte Tensid-Stoffteilchen verwiesen, mit dem Wechselwirkungen zwischen Teilchen bei der Micellenbildung, dem Schmutzlösen, der Verringerung von Oberflächenspannungen usw. auf anschauliche Art und Weise erklärt werden können. Denkt man sich zu dem in Abbildung 1 dargestellten unverzweigten Kohlenwasserstoff-Molekül eine analoge Darstellung eines isomeren, stark verzweigten Moleküls, wird der Einfluss der Struktur auf die Stärke der Wechselwirkung regelrecht bildlich (be)greifbar. Oder man denke an die in vielen Biologiebüchern verbreitete Darstellung von Saccharose-Molekülen als verknüpfte Fünf- und Sechsecke – nichts anderes als eine grafische Darstellung eines Saccharose-Stoffteilchens und eben nicht die Strukturformel von Saccharose-Molekülen.
5 Impulse zum Weiterdenken
- Inwiefern werden die aufgezeigten Probleme A) bis H) minimiert, welche neuen Probleme können sich ergeben?
- Ist es eher hilfreich oder verwirrend, dass im Begriff „Stoffteilchen“ zwei nicht zu vermischende Ebenen, Stoffebene und Teilchenebene, in einem Wort zusammentreffen?
- Müsste der Begriff statt „Stoffteilchen“ nicht zutreffender „Reinstoffteilchen“ lauten, da etwa dem Stoff „Luft“ als Gemisch kein eindeutiges Stoffteilchen zugeordnet werden kann, es somit Stoffe (nämlich Gemische) ohne Stoffteilchen gibt? Oder sollte über eine Definition des Begriffs „Stoff“ im Sinne des bisherigen „Reinstoff“ nachgedacht werden? Dann gäbe es nicht unter dem Oberbegriff „Stoffe“ Reinstoffe und Gemische, sondern unter „Materie“ Stoffe und Stoffgemische.
- So wie die Teilchen der Reinstoffe den eigenen Begriff „Stoffteilchen“ zur genaueren Abgrenzung bekommen, könnten auch die Teilchen, die Atome aufbauen (Protonen, Neutronen und Elektronen), einen eigenen Begriff erhalten, der sie von den physikalischen „Elementarteilchen“ abhebt: Atomteilchen.
Literatur
BARKE, H.-D. et al. (2015). Chemiedidaktik kompakt. 2. Auflage. Springer Spektrum. Berlin, Heidelberg.
JÄCKEL et al. (1996). chemie heute SI 52 und 98. Schroedel. Hannover 1996
JOHNSTONE, A. H. (2000). Teaching of Chemistry - logical or psychological? Chemistry Education: Research and Practice in Europe, 1(1), 9-15.
KREMER, M. & U. BEE (2017). Mehr Transparenz bei den Elementen mit dem PSE. MNU, 70(1), 36 – 42.
SIEVE, B. (2015). Interaktive Tafeln im naturwissenschaftlichen Unterricht - Entwicklung und Evaluation einer Fortbildungsmaßnahme für Chemielehrkräfte. Springer Spektrum. Wiesbaden 2015
TITTEL, C. & M. KREMER (2017). Didaktischer Prüfstand - Wechselwirkungen zwischen Teilchen. In: MNU-Journal 5 343-346. Verlag Klaus Seeberger. Neuss 2017
HARALD THIELEN-REDLICH,
Privates St.-Josef-Gymnasium,
Klosterstraße 2, 54675 Biesdorf, ist Lehrer für Biologie und Chemie.
